I) Dosage du dioxyde de soufre
On souhaite doser une solution S1 de dioxyde de soufre de concentration C1 inconnue.
On dose à l'aide d'une solution de permanganate de potassium S0 de concentration C0 = 0,02 mol.L-1.
1) Calculer la masse de permanganate de potassium nécessaire à la préparation de V = 500 mL de solution S0.
2a) Etablir l'équation-bilan de la réaction de dosage à partir des demi-équations électroniques.
Les couples redox mis en jeu sont SO42- / SO2 et MnO4-/ Mn2+
2b)Etablir un tableau d'avancement.
2c) A l'aide du tableau en déduire une relation entre les quantités de matières en espèce titrantes et titrées.
3) On dose V1 = 10 mL de la solution S1 . A l'équivalence, on a versé V0 = 8,6 mL de solution S0 de permanganate de potassium.
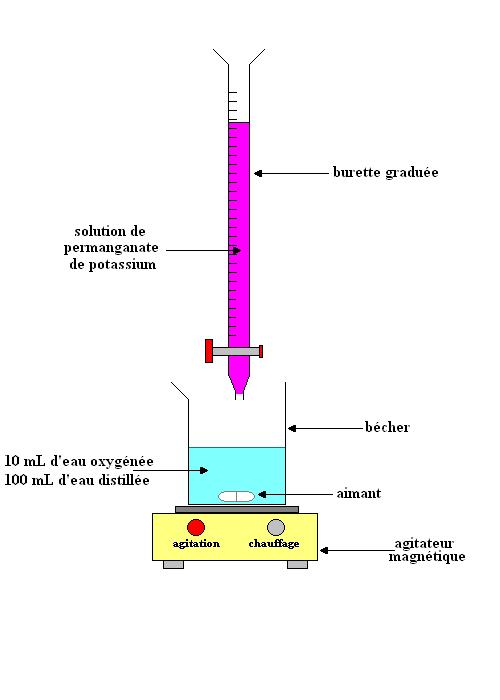
a) Faire un schéma annoté (nom du matériel, nature et formule des solutions ... )de l'ensemble du dispositif de dosage.
b) Comment a-t-on repéré l'équivalence ?
c) Déterminer la concentration C1 de la solution S1 de dioxyde de soufre.
d) Quel volume de dioxyde de soufre a-t-il fallu dissoudre dans V' = 100 mL d'eau pour constituer la solution S1 ? (prendre Vm = 24 L.mol-1).
on donne M(K) = 39 g.mol-1 M(Mn) = 55 g.mol-1
II) Dosage d'une solution de nitrite de sodium
On dose une solution de nitrite de sodium avec une solution de permanganate de potassium.
Lors de la réaction, il se forme des ions manganèse et des ions nitrate NO3-.
Les couples redox mis en jeu sont :NO3- /NO2- et MnO4- / Mn2+
1) Etablir l'équation-bilan de la réaction à partir des demi-équations électroniques.
2) On dispose d'une solution S0 de solution de nitrite de sodium de concentration C0.
On souhaite obtenir par dilution une solution S1 de concentration C1 = C0
a) Calculer le volume V0 de solution S0 à prélever afin de préparer V = 100 mL de solution S1.
b) Faire un schéma annoté et commenter le mode opératoire de cette dilution.
3) On dose V1 = 10 mL de la solution S1 par une solution S2 de permanganate de potassium de concentration C2 = 2.10-2mol.L-1 en présence d'environ 2 mL d'acide sulfurique.
A l'équivalence, on a versé V2= 8,2 mL de solution S2.
a) Faire un schéma annoté (nom du matériel, nature et formule des solutions ... )de l'ensemble du dispositif de dosage.
b) Sachant que les ions nitrite et nitrate sont incolores en solution, comment repère-t-on l'équivalence ?
c) Justifier l'ajout d'acide sulfurique.
d) Etablir un tableau d'avancement.
A l'aide du tableau en déduire une relation entre les quantités de matières en espèce titrantes et titrées.
Déterminer la concentration C1 de la solution S1 de nitrite de sodium. En déduire la concentration C0 de la solution S0.